Batteriestrom - wie entsteht er?
So entsteht der Strom in Batterien und AkkusEine Batterie ist im Grunde genommen nichts anderes als eine Dose voll mit Chemikalien, die Elektronen produzieren. Chemische Reaktionen, die Elektronen produzieren können, nennt man elektrochemische Reaktionen.
Wenn man eine Batterie betrachtet, dann hat sie immer zwei Metallkontakte, die man Pole nennt. Ein Pol ist mit '+' (positiv, Anode) bezeichnet, der andere mit '-' (negativ, Kathode). Bei AA, C oder D-Zellen (normale Taschenlampenbatterien) sind der Boden und der Kopf der Zelle die Pole. In einer großen Autobatterie gibt es zwei große Bleizapfen, die als Pole fungieren.
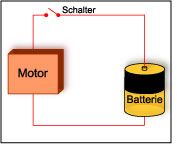 Elektronen sammeln sich am negativen Pol der Batterie. Wenn man die beiden Pole einer Batterie mit einem Kabel verbindet, dann fließen die Elektronen so schnell sie können vom negativen Pol zum positiven Pol (und die Batterie wird sofort leer sein). Außerdem kann dieser Vorgang sehr gefährlich sein - besonders bei großen Batterien - also sollten Sie dieses Experiment besser unterlassen. Normalerweise verbindet man die Pole mit einem "Verbraucher", zum Beispiel einer Glühbirne, einem Radio oder einem Motor.
Elektronen sammeln sich am negativen Pol der Batterie. Wenn man die beiden Pole einer Batterie mit einem Kabel verbindet, dann fließen die Elektronen so schnell sie können vom negativen Pol zum positiven Pol (und die Batterie wird sofort leer sein). Außerdem kann dieser Vorgang sehr gefährlich sein - besonders bei großen Batterien - also sollten Sie dieses Experiment besser unterlassen. Normalerweise verbindet man die Pole mit einem "Verbraucher", zum Beispiel einer Glühbirne, einem Radio oder einem Motor.In der Batterie selbst entstehen die Elektronen durch eine chemische Reaktion. Die Geschwindigkeit, mit der die Elektronen entstehen (interner Widerstand der Batterie) bestimmt dabei, wie viele Elektronen zwischen den Polen fließen können. Die Elektronen fließen von der Batterie in das Kabel und müssen vom negativen zum positiven Pol der Batterie fließen, damit eine chemische Reaktion stattfinden kann. Deshalb kann man eine Batterie relativ lange lagern, ohne dass sie erheblich an Ladung verliert. Denn wenn keine Elektronen vom negativen zum positiven Pol fließen können, findet auch keine chemische Reaktion statt. Wenn man ein Kabel und einen Verbraucher anschließt, dann fängt die chemische Reaktion an.
Die Chemie in der Batterie
Wenn man etwas über die elektrochemischen Reaktionen lernen will, die man benötigt, um eine Batterie herzustellen, kann man zuhause ein einfaches Experiment machen: Um das Experiment durchzuführen benötigt man ein Volt-Ohm-Meter, das man im Elektronikhandel für etwa 15 Euro kaufen kann. Vergewissern Sie sich, dass das Gerät sehr geringen Strom messen kann (im Bereich von 5 bis 10 Milliampere). Dann können Sie genau beobachten, wie sich Ihre Batterie verhält.
Die erste Batterie wurde um 1800 von Alessandro Volta gebaut. Um diese Batterie zu bauen, machte er einen Stapel von unterschiedlichen Schichten aus Zink, Vließpapier, das mit Salzwasser getränkt war und Silber. Das sieht so aus:
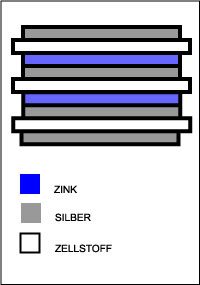 Diese Anordnung bezeichnete man als "Voltischen Stapel". Das obere und untere Ende des Stapels muss jeweils aus verschiedenen Metallen bestehen, wie hier gezeigt. Wenn Sie nun die beiden Sensoren des Messgerätes jeweils an das obere und untere Ende des Stapels halten, können Sie eine Spannung und einen Strom messen. Den Stapel können Sie so groß machen wie Sie wollen und jede Schicht wird die Spannung um einen festen Betrag erhöhen.
Diese Anordnung bezeichnete man als "Voltischen Stapel". Das obere und untere Ende des Stapels muss jeweils aus verschiedenen Metallen bestehen, wie hier gezeigt. Wenn Sie nun die beiden Sensoren des Messgerätes jeweils an das obere und untere Ende des Stapels halten, können Sie eine Spannung und einen Strom messen. Den Stapel können Sie so groß machen wie Sie wollen und jede Schicht wird die Spannung um einen festen Betrag erhöhen.Sie können Ihren eigenen Voltaischen Stapel bauen, indem sie Münzen und Papiertücher verwenden. Lösen Sie Salz in Wasser bis die Lösung gesättigt ist (sich neu hinzukommendes Salz am Boden des Gefäßes absetzt) und tränken das Papiertuch damit. Bauen Sie einen Stapel, indem Sie Eurocent, 50-Cent-Münzen und Papiertücher abwechselnd aufeinander fügen wie es in der Abbildung gezeigt wird. Messen Sie die Spannung und den Strom.
Versuchen Sie es auch mit anderen Metallen und prüfen Sie das Ergebnis: Jede Kombination wird eine etwas andere Spannung und einen anderen Strom erzeugen.
Für ein anderes einfaches Experiment, das Sie ausprobieren können, benötigen Sie ein paar kleinere Glasgefäße wie sie für Baby-Nahrung verwendet werden, eine schwache Säure, einen Draht und Nägel. Füllen Sie das Gläschen mit Zitronensaft oder Essig (schwache Säuren) und geben Sie einen Nagel und ein Stück Kupferdraht so hinein, dass sie sich nicht berühren.
Versuchen Sie es mit verzinkten Nägeln und mit Eisennägeln. Dann messen Sie Spannung und Strom, indem Sie die Sensoren des Messgerätes jeweils an den Draht und den Nagel halten. Sie können den Zitronensaft auch durch Salzwasser ersetzen und werden unterschiedliche Effekte auf Spannung und Strom feststellen.
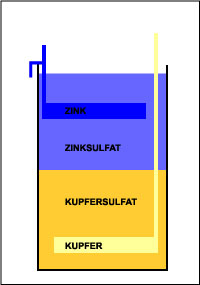 Um 1800, vor der Einführung des elektrischen Generators (dieser wurde erst Ende des 19. Jahrhunderts erfunden), waren Nass-Primär-Zellen sehr verbreitet, um damit Telegraphen und Türklingeln zu betreiben. Diese Nass-Primär-Zellen bestanden aus einer Kupfer- und einer Zinkplatte und Kupfer- und Zinksulfat. Um die Zelle zu fertigen wird die Kupferplatte auf dem Boden eines Glassgefäßes gelegt. Das Gefäß wird dann halb mit Kupfersulfat-Lösung gefüllt. Danach wird eine Zinkplatte in das Gefäß gehängt wie in der Abbildung unten gezeigt. Eine Zinksulfat-Lösung wird anschließend sehr vorsichtig in das Gefäß gefüllt. Kupfersulfat ist dichter und damit schwerer als Zinksulfat, also bleibt es am Boden des Gefäßes, während das Zinksulfat darüber "schwimmt". Klar, dass diese Anordnung für ein Blitzlicht nicht sehr gut funktionieren würde, aber es funktioniert gut für stationäre Anwendungen. Wenn Sie Zugang zu den Materialien haben, können Sie versuchen, Ihre eigene Daniell-Zelle zu bauen. Allerdings verursachen diese Zellen unangenehm riechende Dämpfe, die auch gesundheitsschädlich sein können!
Um 1800, vor der Einführung des elektrischen Generators (dieser wurde erst Ende des 19. Jahrhunderts erfunden), waren Nass-Primär-Zellen sehr verbreitet, um damit Telegraphen und Türklingeln zu betreiben. Diese Nass-Primär-Zellen bestanden aus einer Kupfer- und einer Zinkplatte und Kupfer- und Zinksulfat. Um die Zelle zu fertigen wird die Kupferplatte auf dem Boden eines Glassgefäßes gelegt. Das Gefäß wird dann halb mit Kupfersulfat-Lösung gefüllt. Danach wird eine Zinkplatte in das Gefäß gehängt wie in der Abbildung unten gezeigt. Eine Zinksulfat-Lösung wird anschließend sehr vorsichtig in das Gefäß gefüllt. Kupfersulfat ist dichter und damit schwerer als Zinksulfat, also bleibt es am Boden des Gefäßes, während das Zinksulfat darüber "schwimmt". Klar, dass diese Anordnung für ein Blitzlicht nicht sehr gut funktionieren würde, aber es funktioniert gut für stationäre Anwendungen. Wenn Sie Zugang zu den Materialien haben, können Sie versuchen, Ihre eigene Daniell-Zelle zu bauen. Allerdings verursachen diese Zellen unangenehm riechende Dämpfe, die auch gesundheitsschädlich sein können!Chemische Reaktionen in Batterien
Die wahrscheinlich einfachste Batterie, die man herstellen kann, nennt man Zink/Kohle-Batterie. Wenn man die chemischen Reaktionen versteht, die in dieser Batterie ablaufen, dann versteht man das Funktionsprinzip aller Batterien.
Stellen Sie sich vor, Sie haben ein Gefäß voll Schwefelsäure (H2SO4). Stecken Sie einen Zink-Stab hinein und die Säure wird sofort anfangen, das Zink aufzulösen. Man sieht Wasserstoffbläschen am Zinkstab aufsteigen und das ganze wird sich erwärmen. Hier erfahren Sie was passiert:
- Die Säuremoleküle zerfallen in zwei Arten von Ionen - zwei H+ (Wasserstoff-)Ionen und ein SO4- (Schwefel-Dioxid-)Ion
- Die Zinkatome auf der Oberfläche des Zinkstabes verlieren zwei Elektronen (2e-) um zu Zinkatomen (Zn++) zu werden
- Die Zink++ Atome vereinigen sich mit den SO4-Molekülen zu ZnSO4, das sich in der Säure auflöst
- Die Elektronen der Zinkatome vereinigen sich mit den Wasserstoffionen in der Säure und werden so zu Wasserstoff. Das sind die Bläschen, die am Zinkstab aufsteigen.
Wenn man nun einen Kohlestab in die Säure steckt, passiert zunächst gar nichts. Wenn man aber den Zinkstab und den Kohlestab mit einem Draht verbindet, dann verändern sich zwei Dinge:
- Die Elektronen fließen durch den Draht und vereinigen sich mit dem Wasserstoff des Kohlestabes, Wasserstoffgasbläschen entstehen am Kohlestab.
- Die Wärme nimmt ab. Man kann nun eine Glühbirne oder einen ähnlichen Verbraucher mit Strom versorgen und man kann eine Spannung und einen Strom messen. Die Wärmeenergie wird also in die Bewegungsenergie der Elektronen umgewandelt.
In jeder Batterie tritt die gleiche Art chemischer Reaktionen auf, damit Elektronen von einem Pol zum anderen wandern. Die jeweils eingesetzten Metalle und Elektrolyten beeinflussen die Spannung der Zelle - jeder Aufbau hat eine charakteristische Spannung. Hier lesen Sie zum Beispiel was in einer Autobatterie (Blei-Säure-Akku) vor sich geht:
- Die Zelle hat eine Platte aus Blei und eine andere aus Blei-Dioxyd und eine starke Schwefelsäure als Elektrolyt, in den die beiden Platten eingetaucht sind.
- Blei verbindet sich mit dem SO4 zu PbSO4 plus ein freies Elektron
- Bleidioxyd, Wasserstoff-Ionen und SO4 Ionen plus Elektronen aus der Bleiplatte reagieren zu PbSO4 und Wasser an der Bleidioxyd-Platte
- Wenn sich die Batterie entlädt, bauen beide Platten Bleisulfat (PbSO4) auf und in der Säure bildet sich Wasser. Die Charakteristische Spannung ist ca. 2 Volt pro Zelle. Wenn man also 6 Zellen verbindet erhält man eine 12-Volt-Batterie.
Ein Blei-Säure-Akku hat eine sehr nette Eigenschaft: die chemische Reaktion ist komplett umkehrbar. Wenn man dem Akku Strom mit der richtigen Spannung zuführt, bilden sich auf den Platten wieder Blei und Bleidioxyd und die Batterie lässt sich wieder und wieder verwenden. In einer Zink-Kohle Batterie gibt es keine einfache Möglichkeit, die chemische Reaktion rückgängig zu machen weil es keine einfache Möglichkeit gibt, den Wasserstoff zurück in den Elektrolyt zu bringen.
Moderne Batterien und Akkus haben eine Reihe verschiedener Konzepte mit verschiedenen Chemikalien:
- Zink-Kohle-Batterien, der typische Aufbau aller preiswerten Trockenbatterien
- Alkaline-Mangan-Batterien, die hochwertigen Primärbatterien. Die Elektronen bestehen aus Zink und Mangandioxid
- Lithium Foto-Batterien
- Blei-Säure-Batterien, die in Automobilen verwendet werden. Wiederaufladbares Sekundärsystem
- Nickel-Cadmium Akkus, wiederaufladbare Sekundärzellen
- Nickel-Metall-Hydrid-Akkus, wiederaufladbar. Kein Memory-Effekt wie Nickel-Cadmium-Zellen
- Lithium-Ion-Akkus. Wiederaufladbar, sehr hohe Energiedichte bei geringem Gewicht. Wird deshalb in Notebooks und Mobiltelefonen eingesetzt.
- Zink-Luft-Batterien. Leicht und wiederaufladbar.
- Silber-Zink. Verwendung in der Luftfahrt.
- Metall-Chlorid-Akkus. Verwendung in Elektrofahrzeugen.
